Diplôme universitaire
La plus grande faculté de médecine du monde”
Présentation
Ce Mastère avancé est une incroyable opportunité d'atteindre en un seul programme, chacune des compétences nécessaires pour une intervention complète et actualisée en Oncologie Thoracique et Cardio-Oncologie”
Actuellement, parler d'oncologie, c'est parler d'équipes multidisciplinaires. Il est très important de ne pas perdre cette vision multidisciplinaire, car de nombreuses avancées dans un domaine peuvent avoir des répercussions sur les algorithmes diagnostiques et thérapeutiques utilisés en oncologie. En effet, TECH a pour objectif de permettre aux étudiants de suivre ce Mastère avancé afin d'avoir une vision large et claire de l'oncologie, et d'utiliser la comparaison des avancées scientifiques dans chaque domaine, comme un outil qui permet de développer les compétences.
Ce Mastère avancé permettra aux professionnels d’acquérir des connaissances qui leur seront très utiles dans leur travail quotidien, sur la base d’un travail critique, d’un exposé simple et d’une méthodologie efficace. Nous partons du principe que la simplicité n’est pas incompatible avec la rigueur, et qu’à travers l’acquisition de connaissances clés, un esprit critique émergera qui permettra de mettre en pratique ces connaissances. Pour cela, nous mettons à votre disposition un groupe de professeurs qui sont en «première division “ dans la prise en charge du Cancer, et de nombreux ” leaders internationaux “, qui ont préparé chaque sujet en ” profondeur “ à partir de leur vision de ” super-spécialistes», mais en gardant toujours à l’esprit que le but ultime du Master est que les connaissances puissent être acquises par tout médecin intéressé par les cancers thoraciques et cardiologiques.
De plus, cet itinéraire académique dispose de la méthodologie la plus disruptive sur la scène académique: le Relearning. Grâce à lui, les diplômés évitent de longues heures de mémorisation et peuvent assimiler les concepts les plus complexes en les analysant et en les répétant progressivement. Ce cursus comprend également la participation d'un Directeur International Invité jouissant du plus grand prestige dans le monde de la Cardiologie. Cet expert est en charge de Masterclass exclusives qui permettent aux médecins de mettre à jour leurs compétences de manière efficace et rigoureuse.
Le Directeur International Invité de ce programme cumule de multiples récompenses et une recherche scientifique de pointe dans le domaine de la cardiologie. dans le domaine de la Cardiologie"
Ce Mastère avancé en Oncologie Thoracique et Cardio-Oncologie contient le programme scientifique le plus complet et le plus actualisé du marché. Ses caractéristiques sont les suivantes:
- Développement de cas cliniques présentés par des experts des différentes spécialités
- Contenus graphiques, schématiques et éminemment pratiques avec les dernières informations scientifiques et sanitaires
- Nouveaux développements diagnostiques et thérapeutiques en Gynécologie et Procréation Assistée
- La présentation d'ateliers pratiques sur les procédures, les techniques diagnostiques et thérapeutiques
- Des images réelles en haute résolution et des exercices pratiques où le processus d'auto-évaluation peut être réalisé pour améliorer l'apprentissage
- Système d'apprentissage interactif basé sur des algorithmes pour exercer la prise de décision sur les situations cliniques présentées
- L'accent est mis sur la médecine fondée sur les preuves et les méthodologies de recherche
- Cours théoriques, questions à l'expert, forums de discussion sur des sujets controversés et travail de réflexion individuel
- Les contenus sont disponibles à partir de tout appareil fixe ou portable doté d'une connexion internet
Ce Mastère avancé est le meilleur investissement que vous puissiez faire pour votre avenir. Un processus de formation créé pour être compatible avec votre vie professionnelle et personnelle, qui vous mènera à votre objectif de la manière la plus simple, en optimisant votre temps et vos efforts"
Son corps enseignant est composé des meilleurs professionnels du secteur. Des professionnels en activité qui apportent l'expérience de leur travail à cette spécialisation, ainsi que des spécialistes reconnus appartenant à des sociétés scientifiques de premier plan. Un corps enseignant composé de spécialiste de renom qui mettront leur expérience et leur professionnalisme au service de cette spécialisation.
Grâce à son contenu multimédia développé avec les dernières technologies éducatives, il permettra au professionnel un apprentissage situé et contextuel, c'est-à-dire un environnement simulé qui fournira un apprentissage immersif programmé pour s'entraîner dans des situations réelles.
La conception de ce programme est basée sur l’ Apprentissage par les Problèmes, ainsi le professionnel devra essayer de résoudre les différentes situations de pratique professionnelle qui se présentent à lui tout au long du programme académique. Pour ce faire, le médecin sera assisté d'un système vidéo interactif innovant créé par des experts reconnus dans le domaine de l'Urologie et possédant une grande expérience de l'enseignement.
Rejoignez l'avant-garde médicale avec ce Mastère avancé en Oncologie Thoracique et Cardio-Oncologie. Une formation exceptionnelle et de haute intensité qui vous mènera à un niveau de qualification extraordinaire"
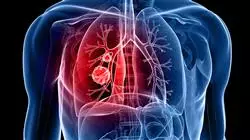
Conçu pour être entièrement abordable, ce Mastère avancé deviendra un outil de croissance professionnelle qui vous mettra au courant de chacun des développements les plus pertinents sur la scène internationale"
Pourquoi étudier à TECH ?
TECH TECH est la plus grande Université numérique du monde. Avec un catalogue impressionnant de plus de 14 000 programmes universitaires, disponibles en 11 langues, elle se positionne comme un leader en matière d'employabilité, avec un taux de placement de 99 %. En outre, elle dispose d'un vaste corps professoral composé de plus de 6 000 professeurs de renommée internationale.

Étudiez dans la plus grande université numérique du monde et assurez votre réussite professionnelle. L'avenir commence à TECH”
La meilleure université en ligne du monde, selon FORBES
Le prestigieux magazine Forbes, spécialisé dans les affaires et la finance, a désigné TECH comme « la meilleure université en ligne du monde ». C'est ce qu'ils ont récemment déclaré dans un article de leur édition numérique dans lequel ils se font l'écho de la réussite de cette institution, « grâce à l'offre académique qu'elle propose, à la sélection de son corps enseignant et à une méthode d'apprentissage innovante visant à former les professionnels du futur ».
Une méthode d'étude innovante, un corps professoral de pointe et une orientation pratique : la clé du succès de TECH.
Les programmes d'études les plus complets sur la scène universitaire
TECH offre les programmes d'études les plus complets sur la scène universitaire, avec des programmes qui couvrent les concepts fondamentaux et, en même temps, les principales avancées scientifiques dans leurs domaines scientifiques spécifiques. En outre, ces programmes sont continuellement mis à jour afin de garantir que les étudiants sont à la pointe du monde universitaire et qu'ils possèdent les compétences professionnelles les plus recherchées. De cette manière, les diplômes de l'université offrent à ses diplômés un avantage significatif pour propulser leur carrière vers le succès
TECH propose les programmes d'études les plus complets et les plus intensifs du panorama universitaire actuel.
Le meilleur personnel enseignant top international
Le corps enseignant de TECH se compose de plus de 6 000 professeurs jouissant du plus grand prestige international. Des professeurs, des chercheurs et des hauts responsables de multinationales, parmi lesquels figurent Isaiah Covington, entraîneur des Boston Celtics, Magda Romanska, chercheuse principale au Harvard MetaLAB, Ignacio Wistumba, président du département de pathologie moléculaire translationnelle au MD Anderson Cancer Center, et D.W. Pine, directeur de la création du magazine TIME, entre autres.
Des experts de renommée internationale, spécialisés dans divers domaines de la Santé, de la Technologie, de la Communication et des Affaires, font partie du corps professoral de TECH.
Une méthode d'apprentissage unique
TECH est la première université à utiliser le Relearning dans tous ses formations. Il s'agit de la meilleure méthodologie d'apprentissage en ligne, accréditée par des certifications internationales de qualité de l'enseignement, fournies par des agences éducatives prestigieuses. En outre, ce modèle académique perturbateur est complété par la « Méthode des Cas », configurant ainsi une stratégie d'enseignement en ligne unique. Des ressources pédagogiques innovantes sont également mises en œuvre, notamment des vidéos détaillées, des infographies et des résumés interactifs
TECH combine le Relearning et la Méthode des Cas dans tous ses programmes universitaires afin de garantir un excellent apprentissage théorique et pratique en étudiant quand et où vous le souhaitez.
La plus grande université numérique du monde
TECH est la plus grande université numérique du monde. Nous sommes la plus grande institution éducative, avec le meilleur et le plus vaste catalogue éducatif numérique, cent pour cent en ligne et couvrant la grande majorité des domaines de la connaissance. Nous proposons le plus grand nombre de diplômes propres, de diplômes officiels de troisième cycle et de premier cycle au monde. Au total, plus de 14 000 diplômes universitaires, dans onze langues différentes, font de nous la plus grande institution éducative au monde.
TECH possède le catalogue de programmes académiques et officiels le plus complet du monde et est disponible dans plus de 11 langues.
Google Partner Premier
Le géant américain de la technologie a décerné à TECH le badge Google Partner Premier. Ce prix, qui n'est décerné qu'à 3 % des entreprises dans le monde, souligne l'expérience efficace, flexible et adaptée que cette université offre aux étudiants. Cette reconnaissance atteste non seulement de la rigueur, de la performance et de l'investissement maximaux dans les infrastructures numériques de TECH, mais positionne également TECH comme l'une des principales entreprises technologiques au monde.
Google a placé TECH dans le top 3% des principales entreprises technologiques du monde en lui attribuant son badge Google Partner Premier.
L’université en ligne officielle de la NBA
TECH est l'université en ligne officielle de la NBA. Grâce à un accord avec la grande ligue de basket-ball, elle offre à ses étudiants des programmes universitaires exclusifs ainsi qu'un large éventail de ressources pédagogiques axées sur les activités de la ligue et d'autres domaines de l'industrie du sport. Chaque programme est conçu de manière unique et comprend des conférenciers exceptionnels : des professionnels ayant un passé sportif distingué qui apporteront leur expertise sur les sujets les plus pertinents.
TECH a été reconnue par la NBA, la première ligue mondiale de basket-ball, comme son université en ligne officielle.
L'université la mieux évaluée par ses étudiants
Les étudiants ont positionné TECH comme l'université la mieux évaluée du monde dans les principaux portails d'opinion, soulignant sa note la plus élevée de 4,9 sur 5, obtenue à partir de plus de 1 000 évaluations. Ces résultats consolident TECH en tant qu'institution universitaire de référence internationale, reflétant l'excellence et l'impact positif de son modèle éducatif”.
TECH est l'université la mieux évaluée au monde par ses étudiants
Leaders en matière d'employabilité
TECH a réussi à devenir l'université leader en matière d'employabilité. 99 % de ses étudiants obtiennent un emploi dans le domaine qu'ils ont étudié dans l'année qui suit la fin de l'un des programmes de l'université. Un nombre similaire parvient à améliorer immédiatement sa carrière. Tout cela grâce à une méthodologie d'étude qui fonde son efficacité sur l'acquisition de compétences pratiques, absolument nécessaires au développement professionnel.
99 % des diplômés TECH trouvent un emploi moins d'un an après la fin de leurs études.
Mastère Avancé en Oncologie Thoracique et Cardio-Oncologie
Face à la variété des conditions oncologiques, le besoin de médecins oncologues qualifiés pour traiter les différentes maladies cancéreuses a augmenté, devenant un besoin primordial pour le secteur. À TECH Global University, nous avons conçu le Mastère Avancé en Oncologie Thoracique et Cardio-Oncologie, un programme visant à spécialiser les médecins professionnels dans les dernières procédures diagnostiques et thérapeutiques utilisées pour le traitement de cette pathologie. Grâce à un programme complet et actualisé, vous couvrirez les principaux aspects de cette discipline et appliquerez vos compétences pour exceller dans votre pratique clinique quotidienne.
Se spécialiser dans la plus grande Faculté de Médecine
L'objectif principal de notre Mastère Avancé est de fournir aux étudiants la plus haute qualification dans l'approche des maladies oncologiques thoraciques et cardiovasculaires par le biais d'un apprentissage théorique et pratique. Vous examinerez en profondeur des concepts et des sujets tels que l'épidémiologie du cancer, les thérapies oncologiques ayant des effets cardiotoxiques et cardioprotecteurs, les situations cliniques complexes dans le contexte de la cardio-oncologie, les bases du traitement en oncologie thoracique, entre autres aspects. Avec un programme scientifique de pointe, vous aurez l'opportunité d'apprendre à travers l'étude et l'analyse de cas réels, l'accompagnement d'experts dans le domaine et le meilleur contenu disponible. Si vous voulez garantir un service complet et de qualité dans la pratique de cette discipline, étudiez dans la plus grande Faculté de Médecine.







