Universitäre Qualifikation
Die größte Fakultät für Krankenpflege der Welt"
Präsentation
Dank dieses 100%igen Online-Programms werden Sie ein umfassendes Verständnis der multiresistenten Bakterien erwerben, von ihrer Epidemiologie bis hin zu ihren Resistenzmechanismen und den besten Praktiken für ihr klinisches Management“

Derzeit stellen multiresistente Bakterien eine große Herausforderung für die Krankenpflege dar, da sie in der Lage sind, gegen mehrere Antibiotika resistent zu sein, was die Behandlung erschwert und die Sterblichkeit und Morbidität bei Krankenhauspatienten erhöht. Daher ist die Durchführung strenger Infektionskontrollmaßnahmen, einschließlich Händewaschen, ordnungsgemäßer Verwendung persönlicher Schutzausrüstung und Desinfektion von Oberflächen, für die Prävention von entscheidender Bedeutung.
Vor diesem Hintergrund präsentiert TECH dieses Programm, das sich mit multiresistenten Bakterien in der Humanpathologie befasst und eine solide Grundlage für die Biologie und Epidemiologie dieser Infektionen bietet. Ein weiterer Schwerpunkt ist die Behandlung von Patienten mit BMR-Infektionen auf der Intensivstation, wo das Pflegepersonal fortschrittliche klinische Managementtechniken und Maßnahmen zur Infektionskontrolle anwenden wird, die für diese kritische Umgebung entscheidend sind.
Ein weiterer Schwerpunkt des Studiengangs sind multiresistente gramnegative Bakterien, die eine besondere Herausforderung darstellen, sowie die Analyse der Antibiotikaresistenz von Streptokokken, Enterokokken und Staphylokokken, die ein detailliertes Verständnis dieser häufigen und gefährlichen Krankheitserreger vermittelt. Ganz zu schweigen von der Proteomik in der klinischen Mikrobiologie, die eine fortgeschrittene Perspektive auf die Analyse von Proteinen bei der Untersuchung von multiresistenten Bakterien bietet.
Schließlich werden das Vorhandensein und der Umgang mit multiresistenten Bakterien in der Nahrungskette bzw. in der Tiergesundheit behandelt, was die Bedeutung eines umfassenden Ansatzes zur Kontrolle der Antibiotikaresistenz in verschiedenen Sektoren unterstreicht. Darüber hinaus werden neue Strategien und neue antimikrobielle Moleküle erforscht und der Einsatz von künstlicher Intelligenz in der klinischen Mikrobiologie und bei Infektionskrankheiten vorgestellt.
Auf diese Weise hat TECH ein umfassendes Programm entwickelt, das vollständig online abläuft, so dass sich die Studenten nicht mehr um die Anreise zu einem Zentrum oder die Anpassung an einen vorgegebenen Stundenplan sorgen müssen. Darüber hinaus basiert es auf der innovativen Relearning-Methode, die in der Wiederholung von Schlüsselkonzepten besteht, um eine optimale und organische Assimilation des Inhalts zu ermöglichen.
Dieses Programm wird Sie mit dem Wissen und den Fähigkeiten fortbilden, die notwendig sind, um eine der dringendsten Herausforderungen in der heutigen Medizin zu bewältigen: Multiresistente Bakterien“
Dieser Privater masterstudiengang in Multiresistente Bakterien für die Krankenpflege enthält das vollständigste und aktuellste wissenschaftliche Programm auf dem Markt. Seine herausragendsten Merkmale sind:
- Entwicklung von Fallstudien, die von Experten für Mikrobiologie, Medizin und Parasitologie vorgestellt werden
- Der anschauliche, schematische und äußerst praxisnahe Inhalt vermittelt alle für die berufliche Praxis unverzichtbaren wissenschaftlichen und praktischen Informationen
- Die praktischen Übungen, bei denen der Selbstbewertungsprozess zur Verbesserung des Lernens durchgeführt werden kann
- Sein besonderer Schwerpunkt liegt auf innovativen Methoden
- Theoretische Lektionen, Fragen an den Experten, Diskussionsforen zu kontroversen Themen und individuelle Reflexionsarbeit
- Die Verfügbarkeit des Zugangs zu Inhalten von jedem festen oder tragbaren Gerät mit Internetanschluss
Sie werden sich mit fortgeschrittenen Themen wie Proteomik in der klinischen Mikrobiologie, neuen Strategien gegen multiresistente Bakterien und der Entwicklung neuer antimikrobieller Moleküle befassen - worauf warten Sie also noch?“
Zu den Dozenten des Programms gehören Fachleute aus der Branche, die ihre Erfahrungen in diese Fortbildung einbringen, sowie anerkannte Spezialisten von führenden Gesellschaften und renommierten Universitäten.
Die multimedialen Inhalte, die mit der neuesten Bildungstechnologie entwickelt wurden, werden der Fachkraft ein situiertes und kontextbezogenes Lernen ermöglichen, d. h. eine simulierte Umgebung, die eine immersive Fortbildung bietet, die auf die Ausführung von realen Situationen ausgerichtet ist.
Das Konzept dieses Programms konzentriert sich auf problemorientiertes Lernen, bei dem die Fachkraft versuchen muss, die verschiedenen Situationen aus der beruflichen Praxis zu lösen, die während des gesamten Studiengangs gestellt werden. Zu diesem Zweck wird sie von einem innovativen interaktiven Videosystem unterstützt, das von renommierten Experten entwickelt wurde.
Sie werden sich mit multiresistenten gramnegativen Bakterien befassen, wobei der Schwerpunkt auf Organismen wie Klebsiella pneumoniae und Pseudomonas aeruginosa liegt. Mit allen Garantien der Qualität der TECH!"

Ein einzigartiges, wichtiges und entscheidendes Fortbildungserlebnis zur Förderung Ihrer beruflichen Entwicklung"
Lehrplan
Zu den Inhalten des Universitätsabschlusses gehört eine detaillierte Untersuchung der Epidemiologie und Pathogenese multiresistenter Bakterien sowie der molekularen Mechanismen der Resistenz. Darüber hinaus werden die Pflegekräfte fortgeschrittene mikrobiologische Diagnosestrategien und Methoden der Infektionskontrolle im Krankenhaus erörtern. Außerdem wird die klinische Behandlung von Patienten mit diesen Infektionen in verschiedenen Pflegeeinrichtungen, von der Intensivstation bis zur Grundversorgung, erörtert. Themen wie die Proteomik in der klinischen Mikrobiologie, die Entwicklung neuer antimikrobieller Therapien und die Rolle der künstlichen Intelligenz bei der Behandlung von Infektionskrankheiten werden das Programm ergänzen.
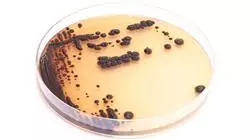
Sie werden sich mit dem fortgeschrittenen Management infizierter Patienten in kritischen Umgebungen, wie z. B. der Intensivstation, sowie mit Strategien zur Infektionskontrolle befassen, um eine nosokomiale Ausbreitung zu verhindern“
Modul 1. Multiresistente Bakterien in der Humanpathologie
1.1. Mechanismen der erworbenen Resistenz gegen Antibiotika
1.1.1. Erwerb von Resistenzgenen
1.1.2. Mutationen
1.1.3. Erwerb von Plasmiden
1.2. Mechanismen der intrinsischen Resistenz gegen Antibiotika
1.2.1. Blockierung des Antibiotika-Eintritts
1.2.2. Änderung des Ziels des Antibiotikums
1.2.3. Inaktivierung des Antibiotikums
1.2.4. Ausscheidung des Antibiotikums
1.3. Chronologie und Entwicklung der Antibiotikaresistenz
1.3.1. Entdeckung der Antibiotikaresistenzen
1.3.2. Plasmide
1.3.3. Entwicklung der Resistenz
1.3.4. Aktuelle Trends in der Entwicklung der Antibiotikaresistenz
1.4. Antibiotikaresistenz in der Humanpathologie
1.4.1. Erhöhte Mortalität und Morbidität
1.4.2. Auswirkungen der Resistenz auf die öffentliche Gesundheit
1.4.3. Wirtschaftliche Kosten im Zusammenhang mit Antibiotikaresistenz
1.5. Multiresistente menschliche Krankheitserreger
1.5.1. Acinetobacter baumannii
1.5.2. Pseudomonas aeruginosa
1.5.3. Enterobacteriaceae
1.5.4. Enterococcus faecium
1.5.5. Staphylococcus aureus
1.5.6. Helicobacter pylori
1.5.7. Campylobacter spp.
1.5.8. Salmonellae
1.5.9. Neisseria gonorrhoeae
1.5.10. . Streptococcus pneumoniae
1.5.11. . Hemophilus influenzae
1.5.12. . Shigella spp.
1.6. Für die menschliche Gesundheit hochgefährliche Bakterien: Aktualisierung der WHO-Liste
1.6.1. Kritische vorrangige Krankheitserreger
1.6.2. Krankheitserreger mit hoher Priorität
1.6.3. Krankheitserreger mittlerer Priorität
1.7. Analyse der Ursachen der Antibiotikaresistenz
1.7.1. Mangel an neuen Antibiotika
1.7.2. Sozioökonomische Faktoren und Gesundheitspolitik
1.7.3. Schlechte Hygiene und sanitäre Einrichtungen
1.7.4. Gesundheitspolitik und Antibiotikaresistenz
1.7.5. Internationale Reisen und globaler Handel
1.7.6. Ausbreitung von Hochrisiko-Klonen
1.7.7. Neu auftretende Krankheitserreger mit Mehrfachresistenz gegen Antibiotika
1.8. Antibiotikagebrauch und -missbrauch in der Gemeinschaft
1.8.1. Verschreibung
1.8.2. Akquisition
1.8.3. Missbrauch von Antibiotika
1.9. Aktueller Stand der weltweiten Antibiotikaresistenz
1.9.1. Globale Statistiken
1.9.2. Mittel- und Südamerika
1.9.3. Afrika
1.9.4. Europa
1.9.5. Nordamerika
1.9.6. Asien und Ozeanien
1.10. Perspektiven der Antibiotikaresistenz.
1.10.1. Strategien zur Entschärfung des Problems der Mehrfachresistenz
1.10.2. Internationale Aktionen
1.10.3. Maßnahmen auf globaler Ebene
Modul 2. Behandlung von Patienten bei Infektionen durch multiresistente Bakterien auf der Intensivstation
2.1. Kolonisierung und Infektion von Patienten auf Intensivstationen
2.1.1. Arten von Intensivstationen
2.1.2. Epidemiologie
2.1.3. Risikofaktoren im Zusammenhang mit Infektionen auf Intensivstationen
2.2. Auswirkungen von nosokomialen Infektionen bei kritisch kranken Patienten
2.2.1. Bedeutung von nosokomialen Infektionen auf Intensivstationen
2.2.2. Risikofaktoren für nosokomiale Infektionen
2.2.2.1. Faktoren des Patienten
2.2.2.2. Faktoren im Umfeld der Intensivstation
2.2.2.3. Faktoren im Zusammenhang mit dem Gesundheitspersonal
2.2.3. Auswirkungen von nosokomialen Infektionen bei immungeschwächten Patienten
2.2.4. Auswirkungen auf die Dauer des Aufenthalts auf der Intensivstation
2.3. Lungenentzündung in Verbindung mit mechanischer Beatmung
2.3.1. Ätiologie
2.3.2. Diagnose
2.3.3. Behandlung
2.4. Katheter-assoziierte Harnwegsinfektionen
2.4.1. Ätiologie
2.4.2. Diagnose
2.4.3. Behandlung
2.5. Primäre Bakteriämien und katheterbedingte Bakteriämien
2.5.1. Ätiologie
2.5.2. Diagnose
2.5.3. Behandlung
2.6. Colitis pseudomembranosa
2.6.1. Ätiologie
2.6.2. Diagnose
2.6.3. Behandlung
2.7. Infektionen mit opportunistischen Krankheitserregern
2.7.1. Ätiologie
2.7.2. Diagnose
2.7.3. Behandlung
2.8. Angemessener Einsatz von Antibiotika
2.8.1. Programme zur Optimierung des Antibiotikaeinsatzes (PROA) auf der Intensivstation
2.8.2. Strategien der Antibiotikatherapie für die Behandlung von gramnegativen Bakterien
2.8.3. Strategien der Antibiotikatherapie für die Behandlung von grampositiven Bakterien
2.8.4. Strategien der Antibiotikatherapie für die Behandlung von Koinfektionen
2.9. Strategien zur Prävention von Infektionen Infektionen durch multiresistente Bakterien auf der Intensivstation
2.9.1. Hygienemaßnahmen
2.9.2. Maßnahmen zur Infektionskontrolle
2.9.3. Protokolle und Leitlinien für die klinische Praxis
2.9.4. Fortbildung und Schulung des Personals der Intensivstation
2.9.5. Einbindung der Patienten und ihrer Familien
2.10. Strategien zur Infektionsprävention auf der Intensivstation
2.10.1. Strategien zur Infektionsprävention auf der Intensivstation nach Infektionsherd
2.10.1.1. Pneumonie
2.10.1.2. Bakteriämie
2.10.1.3. Harnwegsinfektion
2.10.2. Bewertung und Qualitätsindikatoren in der Infektionsprävention
2.10.3. Instrumente zur Bewertung und kontinuierlichen Verbesserung
2.10.4. Beispiele für erfolgreiche Infektionsprävention auf Intensivstationen
Modul 3. Multiresistente gramnegative Bakterien
3.1. Infektionen durch gramnegative Mikroorganismen
3.1.1. Epidemiologie von gramnegativen Mikroorganismen
3.1.2. Gemeinschafts- und nosokomiale Infektionen durch gramnegative Mikroorganismen
3.1.3. Relevanz von Infektionen mit multiresistenten gramnegativen Mikroorganismen
3.2. Pathogenese von Infektionen mit gramnegativen Mikroorganismen
3.2.1. Faktoren im Zusammenhang mit gramnegativen Mikroorganismen
3.2.2. Patientenfaktoren bei gramnegativen Infektionen
3.2.3. Andere Faktoren bei gramnegativen Infektionen
3.3. Klinische Beurteilung von Patienten mit multiresistenten gramnegativen Infektionen
3.3.1. Anamnese
3.3.2. Klinische Beurteilung der Patienten
3.3.3. Andere Informationen von Interesse
3.4. Ergänzende Tests bei multiresistenten gramnegativen Infektionen
3.4.1. Blutuntersuchungen
3.4.2. Bildgebende Tests
3.4.3. Mikrobiologische Techniken
3.5. Einschätzung des Schweregrads bei Patienten mit multiresistenten gramnegativen Infektionen
3.5.1. Traditioneller Ansatz zur Einschätzung des Schweregrads
3.5.2. Neue Instrumente zur Einschätzung des Schweregrads
3.5.3. Praktische Schlussfolgerungen
3.6. Risiko des Erwerbs von Infektionen mit multiresistenten gramnegativen Mikroorganismen
3.6.1. Klinische Faktoren beim Erwerb von multiresistenten gramnegativen Infektionen
3.6.2. Weitere Faktoren für den Erwerb multiresistenter gramnegativer Infektionen
3.6.3. Instrumente zur Abschätzung des Risikos des Auftretens multiresistenter gramnegativer Mikroorganismen
3.7. Empirische Behandlung bei Verdacht auf multiresistente gramnegative Infektionen
3.7.1. Beteiligte Mikroorganismen je nach Standort
3.7.2. Umfassende Beurteilung von Patienten mit Verdacht auf multiresistente gramnegative Infektionen
3.7.3. Auswahl einer empirischen Antibiotikabehandlung
3.8. Gezielte Therapie bei multiresistenten gramnegativen Infektionen
3.8.1. Anpassung der Antibiotikatherapie entsprechend den mikrobiologischen Ergebnissen
3.8.2. Nachsorge von multiresistenten gramnegativen Infektionen
3.8.3. Wichtigste Nebenwirkungen einer Antibiotikatherapie
3.9. Dauer der Antibiotikatherapie bei multiresistenten gramnegativen Infektionen
3.9.1. Schätzung der Dauer der Antibiotikabehandlung bei multiresistenten gramnegativen Infektionen
3.9.2. Relevanz der Fokuskontrolle bei multiresistenten gramnegativen Infektionen
3.9.3. Besondere Überlegungen zur Antibiotikatherapie bei diesen Infektionen
3.10. PROA-Teams bei multiresistenten gramnegativen Infektionen
3.10.1. PROA-Teams: Geschichte
3.10.2. Auswirkungen der PROA-Teams auf die korrekte Anwendung von Antibiotika-Behandlungen
3.10.3. Herausforderung für PROA-Teams bei der Behandlung multiresistenter gramnegativer Infektionen
Modul 4. Antibiotikaresistenz bei Streptokokken, Enterokokken und Staphylokokken
4.1. Grampositive bakterielle Infektionen
4.1.1. Natürlicher Lebensraum von grampositiven Krankheitserregern
4.1.2. Nosokomiale Infektionen durch grampositive Bakterien
4.1.3. In der Gemeinschaft erworbene Infektionen durch grampositive Bakterien
4.2. In-vitro- und In-vivo-Systeme zur Untersuchung von Resistenzen bei grampositiven Bakterien
4.2.1. Biofilme
4.2.2. Zelluläre Modelle
4.2.3. Tiermodelle
4.3. Streptococcus pneumoniae
4.3.1. Klinische Relevanz
4.3.2. Resistenzmechanismen
4.3.3. Biofilme
4.3.4. Behandlungsmöglichkeiten
4.4. Streptococcus pyogenes
4.4.1. Klinische Relevanz
4.4.2. Resistenzmechanismen
4.4.3. Biofilme
4.4.4. Behandlungsmöglichkeiten
4.5. Streptococcus agalactiae
4.5.1. Klinische Relevanz
4.5.2. Resistenzmechanismen
4.5.3. Biofilme
4.5.4. Behandlungsmöglichkeiten
4.6. Enterococcus faecalis
4.6.1. Klinische Relevanz
4.6.2. Resistenzmechanismen
4.6.3. Biofilme
4.6.4. Behandlungsmöglichkeiten
4.7. Enterococcus faecium
4.7.1. Klinische Relevanz
4.7.2. Resistenzmechanismen
4.7.3. Biofilme
4.7.4. Behandlungsmöglichkeiten
4.8. Staphylokokkus aureus
4.8.1. Klinische Relevanz
4.8.2. Resistenzmechanismen
4.8.3. Biofilme
4.8.4. Behandlungsmöglichkeiten
4.9. Mycobacterium tuberculosis
4.9.1. Klinische Relevanz
4.9.2. Resistenzmechanismen
4.9.3. Behandlungsmöglichkeiten
4.10. Resistenz bei anderen grampositiven Bakterien
4.10.1. Koagulasenegative Staphylococcus
4.10.2. Clostridioides difficile
4.10.3. Neu auftretende grampositive Krankheitserreger
Modul 5. Proteomik in der klinischen Mikrobiologie
5.1. Proteomik im mikrobiologischen Labor
5.1.1. Evolution und Entwicklung der Proteomik
5.1.2. Bedeutung für die mikrobiologische Diagnose
5.1.3. Proteomik von multiresistenten Bakterien
5.2. Qualitative Proteintrennungstechniken
5.2.1. Zweidimensionale Elektrophorese (2DE)
5.2.2. DIGE-Technologie
5.2.3. Anwendungen in der Mikrobiologie
5.3. Quantitative Proteintrennungstechniken
5.3.1. Isotopische Markierung
5.3.2. Hochleistungsflüssigkeitschromatographie (HPLC)
5.3.3. Massenspektrometrie (MS)
5.3.3.1. MALDI-TOF-Technologien im klinisch-mikrobiologischen Labor
5.3.3.1.1. VITEK®MS-System
5.3.3.1.2. MALDI Biotyper®-System
5.4. MALDI-TOF-Anwendungen in der klinischen Mikrobiologie
5.4.1. Identifizierung von Mikroorganismen
5.4.2. Charakterisierung der Antibiotikaresistenz
5.4.3. Bakterielle Typisierung
5.5. Bioinformatik-Tools für die Proteomik
5.5.1. Proteomische Datenbanken
5.5.2. Werkzeuge für die Proteinsequenzanalyse
5.5.3. Visualisierung von Proteomikdaten
5.6. Genomik im mikrobiologischen Labor
5.6.1. Evolution und Entwicklung der Genomik
5.6.2. Bedeutung für die mikrobiologische Diagnose
5.6.3. Genomik von multiresistenten Bakterien
5.7. Arten der Sequenzierung
5.7.1. Sequenzierung von Genen mit taxonomischem Wert
5.7.2. Sequenzierung von Antibiotikaresistenzgenen
5.7.3. Massive Sequenzierung
5.8. Anwendungen der massiven Sequenzierung in der klinischen Mikrobiologie
5.8.1. Vollständige Sequenzierung des bakteriellen Genoms
5.8.2. Vergleichende Genomik
5.8.3. Epidemiologische Überwachung
5.8.4. Studien zur mikrobiellen Vielfalt und Evolution
5.9. Bioinformatik-Tools für die Genomik
5.9.1. Genomische Datenbanken
5.9.2. Werkzeuge für die Sequenzanalyse
5.9.3. Visualisierung von genomischen Daten5.10. Futuro de la genómica y proteómica en el laboratorio clínico.
5.10. Die Zukunft der Genomik und Proteomik im klinischen Labor
5.10.1. Aktuelle und künftige Entwicklungen in der Genomik und Proteomik
5.10.2. Entwicklung neuer therapeutischer Strategien
5.10.3. Technische und bioinformatische Herausforderungen
5.10.4. Ethische und regulatorische Implikationen
Modul 6. Multiresistente Bakterien in der Nahrungskette
6.1. Multiresistente Bakterien in der Nahrungskette
6.1.1. Die Rolle der Nahrungskette bei der Verbreitung der antimikrobiellen Resistenz
6.1.2. Antimikrobielle Resistenz in Lebensmitteln (ESBL, MRSA und Colistin)
6.1.3. Die Nahrungskette im Rahmen des One-Health-Konzepts
6.2. Verbreitung der Resistenz gegen antimikrobielle Mittel durch Lebensmittel
6.2.1. Lebensmittel tierischen Ursprungs
6.2.2. Lebensmittel pflanzlichen Ursprungs
6.2.3. Verbreitung von resistenten Bakterien über das Wasser
6.3. Verbreitung resistenter Bakterien in der Lebensmittelproduktion
6.3.1. Verbreitung resistenter Bakterien im Umfeld der Lebensmittelproduktion
6.3.2. Verbreitung resistenter Bakterien durch Lebensmittelarbeiter
6.3.3. Kreuzresistenz zwischen Bioziden und Antibiotika
6.4. Resistenz gegen antimikrobielle Mittel bei Salmonella spp.
6.4.1. Salmonella spp., die AmpC, ESBL und Carbapenemasen produzieren
6.4.2. Resistente Salmonella spp. beim Menschen
6.4.3. Antibiotikaresistente Salmonella spp. bei Nutz- und Fleischtieren
6.4.4. Multiresistente Salmonella spp.
6.5. Resistenz gegen antimikrobielle Mittel bei Campylobacter spp.
6.5.1. Resistenz gegen antimikrobielle Mittel bei Campylobacter spp.
6.5.2. Antibiotikaresistente Campylobacter spp. in Lebensmitteln
6.5.3. Multiresistente Campylobacter spp.
6.6. Antimikrobielle Resistenz bei Escherichia coli
6.6.1. E. coli., die AmpC, ESBL und Carbapenemasen produzieren
6.6.2. Antibiotikaresistente E. coli bei Nutztieren
6.6.3. Antibiotikaresistente E. coli in Lebensmitteln
6.6.4. Multiresistente E. coli
6.7. Antimikrobielle Resistenz bei Staphylokokken
6.7.1. Methicillin-resistenter S. aureus (MRSA)
6.7.2. MRSA in Lebensmitteln und Nutztieren
6.7.3. Methicillin-resistente Staphylococcuys epidermidis (MRSE)
6.7.4. Multiresistente Staphylococcus spp.
6.8. Antimikrobielle Resistenz bei Enterobacteriaceae
6.8.1. Shigella spp.
6.8.2. Enterobacter spp.
6.8.3. Andere Enterobakterien aus der Umwelt
6.9. Antimikrobielle Resistenz bei anderen lebensmittelbedingten Krankheitserregern
6.9.1. Listeria monocytogenes
6.9.2. Enterococcus spp.
6.9.3. Pseudomonas spp.
6.9.4. Aeromonas spp. und Plesiomonas spp.
6.10. Strategien zur Verhinderung und Kontrolle der Ausbreitung von mikrobiellen Resistenzen in der Lebensmittelkette
6.10.1. Präventiv- und Kontrollmaßnahmen in der Primärproduktion
6.10.2. Präventiv- und Kontrollmaßnahmen in Schlachthöfen
6.10.3. Präventiv- und Kontrollmaßnahmen in der Lebensmittelindustrie
Modul 7. Antimikrobielle Resistenz in der Tiergesundheit
7.1. Antibiotika im Bereich der Tiermedizin
7.1.1. Verschreibung
7.1.2. Akquisition
7.1.3. Missbrauch von Antibiotika
7.2. Multiresistente Bakterien im Veterinärbereich
7.2.1. Ursachen für bakterielle Resistenzen im Veterinärbereich
7.2.2. Verbreitung von Antibiotikaresistenzgenen (ARGs), insbesondere durch horizontale Übertragung mittels Plasmiden
7.2.3. Mobiles Colistin-Resistenzgen (mcr)
7.3. Multiresistente Bakterienarten von veterinärmedizinischer Bedeutung
7.3.1. Krankheitserreger in Haustieren
7.3.2. Krankheitserreger bei Rindern
7.3.3. Krankheitserreger beim Schwein
7.3.4. Krankheitserreger bei Geflügel
7.3.5. Krankheitserreger bei Ziegen und Schafen
7.3.6. Krankheitserreger bei Fischen und Wassertieren
7.4. Auswirkungen von multiresistenten Bakterien auf die Tiergesundheit
7.4.1. Tierleid und Verluste
7.4.2. Beeinträchtigung der Lebensgrundlagen der Haushalte
7.4.3. Erzeugung von „Superbugs“
7.5. Multiresistente Bakterien in der Umwelt und in der Tierwelt
7.5.1. Antibiotikaresistente Bakterien in der Umwelt
7.5.2. Antibiotikaresistente Bakterien in der Tierwelt
7.5.3. Antibiotikaresistente Bakterien in Meeres- und Binnengewässern
7.6. Auswirkungen der bei Tieren und in der Umwelt festgestellten Resistenzen auf die öffentliche Gesundheit
7.6.1. Gemeinsame Antibiotika in der Veterinär- und Humanmedizin
7.6.2. Übertragung von Resistenzen vom Tier auf den Menschen
7.6.3. Übertragung von Resistenzen aus der Umwelt auf den Menschen
7.7. Prävention und Kontrolle
7.7.1. Vorbeugende Maßnahmen gegen bakterielle Resistenzen bei Tieren
7.7.2. Systeme und Verfahren für den wirksamen Einsatz von Antibiotika
7.7.3. Die Rolle von Tierärzten und Tierhaltern bei der Prävention von bakterieller Resistenz
7.7.4. Behandlungen und Alternativen zu Antibiotika bei Tieren
7.7.5. Instrumente zur Begrenzung des Auftretens von antimikrobiellen Resistenzen und ihrer Verbreitung in der Umwelt7.8. Planes estratégicos para reducir el riesgo de selección y diseminación de la resistencia a los antibióticos
7.8. Strategische Pläne zur Verringerung des Risikos der Selektion und Verbreitung von Antibiotikaresistenzen
7.8.1. Überwachung und Kontrolle des Einsatzes kritischer Antibiotika
7.8.2. Bildung und Forschung
7.8.3. Kommunikation und Prävention
7.9. One-Health-Strategie
7.9.1. Definition und Ziele der One-Health-Strategie
7.9.2. Anwendung der One-Health-Strategie bei der Bekämpfung multiresistenter Bakterien
7.9.3. Erfolgsgeschichten bei der Anwendung der One-Health-Strategie
7.10. Klimawandel und Antibiotikaresistenz
7.10.1. Zunahme von Infektionskrankheiten
7.10.2. Extreme Wetterbedingungen
7.10.3. Verlagerung von Populationen
Modul 8. Neue Strategien gegen multiresistente Bakterien
8.1. CRISPR-Cas9-Genbearbeitung
8.1.1. Molekularer Wirkmechanismus
8.1.2. Anwendungen
8.1.2.1. CRISPR-Cas9 als therapeutisches Mittel
8.1.2.2. Entwicklung von probiotischen Bakterien
8.1.2.3. Schneller Nachweis von Resistenzen
8.1.2.4. Entfernung von Resistenzplasmiden
8.1.2.5. Entwicklung neuer Antibiotika
8.1.2.6. Sicherheit und Stabilität
8.1.3. Beschränkungen und Herausforderungen
8.2. Vorübergehende kollaterale Sensibilisierung (SCT)
8.2.1. Molekularer Mechanismus
8.2.2. Vorteile und Anwendungen von SCT
8.2.3. Beschränkungen und Herausforderungen
8.3. Gen-Stilllegung
8.3.1. Molekularer Mechanismus
8.3.2. RNA-Interferenz
8.3.3. Antisense-Oligonukleotide
8.3.4. Vorteile und Anwendungen der Gen-Stilllegung
8.3.5. Beschränkungen
8.4. Sequenzierung mit hohem Durchsatz
8.4.1. Schritte der Hochdurchsatz-Sequenzierung
8.4.2. Bioinformatik-Tools für den Kampf gegen multiresistente Bakterien
8.4.3. Herausforderungen
8.5. Nanopartikel
8.5.1. Wirkungsmechanismus gegen Bakterien
8.5.2. Klinische Anwendungen
8.5.3. Beschränkungen und Herausforderungen
8.6. Entwicklung von probiotischen Bakterien
8.6.1. Herstellung von antimikrobiellen Molekülen
8.6.2. Bakterieller Antagonismus
8.6.3. Modulation des Immunsystems
8.6.4. Klinische Anwendungen
8.6.4.1. Prävention von nosokomialen Infektionen
8.6.4.2. Verringerung der Inzidenz von Atemwegsinfektionen
8.6.4.3. Ergänzende Therapie bei der Behandlung von Harnwegsinfektionen
8.6.4.4. Prävention von resistenten Hautinfektionen
8.6.5. Beschränkungen und Herausforderungen
8.7. Antibakterielle Impfstoffe
8.7.1. Arten von Impfstoffen gegen bakterielle Krankheiten
8.7.2. In der Entwicklung befindliche Impfstoffe gegen die wichtigsten multiresistenten Bakterien
8.7.3. Herausforderungen und Überlegungen
8.8. Bakteriophagen
8.8.1. Wirkungsmechanismus
8.8.2. Lytischer Zyklus von Bakteriophagen
8.8.3. Lysogener Zyklus von Bakteriophagen
8.9. Phagen-Therapie
8.9.1. Isolierung und Transport von Bakteriophagen
8.9.2. Aufreinigung und Handhabung von Bakteriophagen im Labor
8.9.3. Phänotypische und genetische Charakterisierung von Bakteriophagen
8.9.4. Präklinische und klinische Versuche
8.9.5. Mitfühlender Einsatz von Phagen und Erfolgsgeschichten
8.10. Antibiotika-Kombinationstherapie
8.10.1. Wirkungsmechanismen
8.10.2. Wirksamkeit und Risiken
8.10.3. Herausforderungen und Beschränkungen
8.10.4. Kombinierte Antibiotika- und Phagentherapie
Modul 9. Neue antimikrobielle Moleküle
9.1. Neue antimikrobielle Moleküle
9.1.1. Der Bedarf an neuen antimikrobiellen Molekülen
9.1.2. Auswirkungen neuer Moleküle auf die antimikrobielle Resistenz
9.1.3. Herausforderungen und Chancen bei der Entwicklung neuer antimikrobieller Moleküle
9.2. Methoden für die Entdeckung neuer antimikrobieller Moleküle
9.2.1. Traditionelle Ansätze zur Entdeckung
9.2.2. Fortschritte in der Screening-Technologie
9.2.3. Rationale Strategien zur Entwicklung von Arzneimitteln
9.2.4. Biotechnologie und funktionelle Genomik
9.2.5. Andere innovative Ansätze
9.3. Neue Penicilline: Neue Medikamente und ihre künftige Rolle in der Antiinfektivatherapie
9.3.1. Klassifizierung
9.3.2. Wirkungsmechanismus
9.3.3. Antimikrobielles Spektrum
9.3.4. Therapeutische Anwendungen
9.3.5. Nebenwirkungen
9.3.6. Präsentation und Dosierung
9.4. Cephalosporine
9.4.1. Klassifizierung
9.4.2. Wirkungsmechanismus
9.4.3. Antimikrobielles Spektrum
9.4.4. Therapeutische Anwendungen
9.4.5. Nebenwirkungen
9.4.6. Präsentation und Dosierung
9.5. Carbapenemika und Monobactame
9.5.1. Klassifizierung
9.5.2. Wirkungsmechanismus
9.5.3. Antimikrobielles Spektrum
9.5.4. Therapeutische Anwendungen
9.5.5. Nebenwirkungen
9.5.6. Präsentation und Dosierung
9.6. Zyklische Glykopeptide und Lipopeptide
9.6.1. Klassifizierung
9.6.2. Wirkungsmechanismus
9.6.3. Antimikrobielles Spektrum
9.6.4. Therapeutische Anwendungen
9.6.5. Nebenwirkungen
9.6.6. Präsentation und Dosierung
9.7. Makrolide, Ketolide und Tetrazykline
9.7.1. Klassifizierung
9.7.2. Wirkungsmechanismus
9.7.3. Antimikrobielles Spektrum
9.7.4. Therapeutische Anwendungen
9.7.5. Nebenwirkungen
9.7.6. Präsentation und Dosierung
9.8. Aminoglykoside und Quinolone
9.8.1. Klassifizierung
9.8.2. Wirkungsmechanismus
9.8.3. Antimikrobielles Spektrum
9.8.4. Therapeutische Anwendungen
9.8.5. Nebenwirkungen
9.8.6. Präsentation und Dosierung
9.9. Lincosamide, Streptogramine und Oxazolidinone
9.9.1. Klassifizierung
9.9.2. Wirkungsmechanismus
9.9.3. Antimikrobielles Spektrum
9.9.4. Therapeutische Anwendungen
9.9.5. Nebenwirkungen
9.9.6. Präsentation und Dosierung
9.10. Rifamycine und andere neue antimikrobielle Moleküle
9.10.1. Rifamycine: Klassifizierung
9.10.1.2. Wirkungsmechanismus
9.10.1.3. Antimikrobielles Spektrum
9.10.1.4. Therapeutische Anwendungen
9.10.1.5. Nebenwirkungen
9.10.1.6. Präsentation und Dosierung
9.10.2. Antibiotika natürlichen Ursprungs
9.10.3. Synthetische antimikrobielle Mittel
9.10.4. Antimikrobielle Peptide
9.10.5. Antimikrobielle Nanopartikel
Modul 10. Künstliche Intelligenz in der klinischen Mikrobiologie und bei Infektionskrankheiten
10.1. Künstliche Intelligenz (KI) in der klinischen Mikrobiologie und bei Infektionskrankheiten
10.1.1. Aktuelle Erwartungen an die KI in der klinischen Mikrobiologie
10.1.2. Aufstrebende Bereiche, die mit KI verknüpft sind
10.1.3. Transversalität der KI
10.2. Techniken der künstlichen Intelligenz (KI) und andere ergänzende Technologien, die auf die klinische Mikrobiologie und Infektionskrankheiten angewendet werden
10.2.1. Logik und KI-Modelle
10.2.2. Technologien für KI
10.2.2.1. Machine Learning
10.2.2.2. Deep Learning
10.2.2.3. Datenwissenschaft und Big Data
10.3. Künstliche Intelligenz (KI) in der Mikrobiologie
10.3.1. KI in der Mikrobiologie: Geschichte und Entwicklung
10.3.2. KI-Technologien, die in der Mikrobiologie eingesetzt werden können
10.3.3. Forschungsziele der KI in der Mikrobiologie
10.3.3.1. Verständnis der bakteriellen Vielfalt
10.3.3.2. Erforschung der bakteriellen Physiologie
10.3.3.3. Erforschung der bakteriellen Pathogenität
10.3.3.4. Epidemiologische Überwachung
10.3.3.5. Entwicklung von antimikrobiellen Therapien
10.3.3.6. Mikrobiologie in Industrie und Biotechnologie
10.4. Klassifizierung und Identifizierung von Bakterien durch künstliche Intelligenz (KI)
10.4.1. Maschinelle Lerntechniken für die Identifizierung von Bakterien
10.4.2. Taxonomie multiresistenter Bakterien mithilfe von KI
10.4.3. Praktische Umsetzung von KI in klinischen und Forschungslabors in der Mikrobiologie
10.5. Entschlüsselung bakterieller Proteine
10.5.1. KI-Algorithmen und -Modelle für die Vorhersage von Proteinstrukturen
10.5.2. Anwendungen zur Identifizierung und zum Verständnis von Resistenzmechanismen
10.5.3. Praktische Anwendung: AlphaFold und Rosetta
10.6. Entschlüsselung des Genoms von multiresistenten Bakterien
10.6.1. Identifizierung von Resistenzgenen
10.6.2. Genomische Big-Data-Analyse: KI-gestützte Sequenzierung von Bakteriengenomen
10.6.3. Praktische Anwendung: Identifizierung von Resistenzgenen
10.7. Strategien mit künstlicher Intelligenz (KI) in Mikrobiologie und öffentlicher Gesundheit
10.7.1. Management von Infektionsausbrüchen
10.7.2. Epidemiologische Überwachung
10.7.3. KI für personalisierte Behandlungen
10.8. Künstliche Intelligenz (KI) zur Bekämpfung bakterieller Resistenzen gegen Antibiotika
10.8.1. Optimierung des Einsatzes von Antibiotika
10.8.2. Vorhersagemodelle für die Entwicklung der antimikrobiellen Resistenz
10.8.3. Gezielte Therapie auf der Grundlage der KI-basierten Entwicklung neuer Antibiotika
10.9. Zukunft der künstlichen Intelligenz (KI) in der Mikrobiologie
10.9.1. Synergien zwischen Mikrobiologie und KI
10.9.2. Linien der KI-Implementierung in der Mikrobiologie
10.9.3. Langfristige Vision der Auswirkungen von KI im Kampf gegen multiresistente Bakterien
10.10. Technische und ethische Herausforderungen bei der Implementierung von künstlicher Intelligenz (KI) in der Mikrobiologie
10.10.1. Rechtliche Erwägungen
10.10.2. Ethische und haftungsrechtliche Überlegungen
10.10.3. Hindernisse für die Einführung von KI
10.10.3.1. Technische Hindernisse
10.10.3.2. Soziale Hindernisse
10.10.3.3. Wirtschaftliche Hindernisse
10.10.3.4. Cybersicherheit

Das Programm Multiresistente Bakterien für die Krankenpflege bietet Ihnen einen umfassenden Lehrplan, der eine Vielzahl von Themen abdeckt, die im Kampf gegen multiresistente bakterielle Infektionen von entscheidender Bedeutung sind“
Privater Masterstudiengang in Multiresistente Bakterien für die Krankenpflege
Wenn Sie Pflegekraft sind und sich auf das Management und die Kontrolle von Infektionen spezialisieren wollen, die durch Bakterien verursacht werden, die gegen mehrere Antibiotika resistent sind, dann sind Sie hier genau richtig. An der TECH Technologischen Universität finden Sie einen kompletten Masterstudiengang, der Ihnen helfen wird, Ihre akademischen Ziele zu erreichen. Dieser Studiengang, der zu 100% online unterrichtet wird, bietet Ihnen ein gründliches Verständnis und praktische Fähigkeiten, die für die Bewältigung einer der größten Herausforderungen im heutigen Gesundheitswesen unerlässlich sind. Während der Fortbildung werden Sie sich mit den Mechanismen der bakteriellen Resistenz, der Epidemiologie multiresistenter Bakterien und Strategien zur Infektionsprävention und -kontrolle im Krankenhaus und in der Gemeinde befassen. Darüber hinaus werden Schlüsselthemen wie die Identifizierung und Behandlung resistenter bakterieller Infektionen, der rationale Einsatz von Antibiotika und die Umsetzung von Biosicherheitsprotokollen zur Eindämmung der Ausbreitung dieser Infektionen behandelt. Ein herausragendes Merkmal dieses Programms ist sein praktischer und evidenzbasierter Ansatz, der Sie in die Lage versetzt, kritische Fähigkeiten bei der klinischen Entscheidungsfindung, der Entwicklung individualisierter Behandlungsstrategien und der Aufklärung von Patienten oder Kollegen über den angemessenen Einsatz von antimikrobiellen Mitteln zu entwickeln.
Erwerben Sie einen Masterstudiengang in Multiresistente Bakterien für die Krankenpflege
Der Online-Modus des Programms bietet Flexibilität und Zugänglichkeit, so dass Sie von überall und zu Zeiten, die Ihren beruflichen und privaten Verpflichtungen entsprechen, auf die Inhalte zugreifen können. Über eine fortschrittliche Bildungsplattform profitieren Sie von interaktiven Ressourcen und aktuellen Studienmaterialien, die Ihre Lernerfahrung erheblich bereichern. Die Fortbildung wird von einem Team von Fachleuten geleitet, die über umfangreiche Erfahrungen im Umgang mit multiresistenten Bakterien und in der Pflegebereitschaft verfügen und die Sie während des gesamten Programms fachkundig anleiten und unterstützen. Ihre klinische Erfahrung und ihr aktuelles Wissen stellen sicher, dass Sie eine qualitativ hochwertige Fortbildung erhalten, die den aktuellen Anforderungen des Gesundheitswesens gerecht wird. Die Einschreibung in diesen Masterstudiengang ist eine strategische Entscheidung, um im Management komplexer Infektionen führend zu sein und die Qualität der Pflege in Ihrem Arbeitsumfeld zu verbessern. Dieser fortgeschrittene Abschluss liefert das notwendige Rüstzeug, um die Herausforderung multiresistenter Bakterien wirksam anzugehen und so zur Patientensicherheit und öffentlichen Gesundheit beizutragen.







